
Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Открита е цел за неутрализиране на токсични протеини при болестта на Паркинсон
Последно прегледани: 02.07.2025
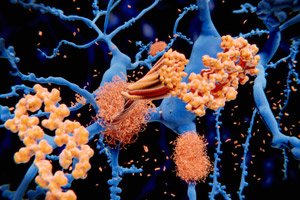 ">
">Изследователи от UAB (Автономния университет на Барселона) са идентифицирали място в ранните агрегати на алфа-синуклеиновия протеин, което може да бъде насочено към предотвратяване на превръщането му в токсични амилоидни фибрили, които се натрупват в мозъците на хора с болестта на Паркинсон.
Откритието е публикувано наскоро в Journal of the American Chemical Society в проучване, което задълбочава разбирането за структурните свойства на тези първоначални агрегати или олигомери и отваря вратата за разработване на нови терапевтични стратегии за тяхното инактивиране.
Проучването е проведено от учените Салвадор Вентура, Хайме Сантос, Хорди Пухолс и Иранцу Палхарес от Института по биотехнологии и биомедицина (IBB) и Катедрата по биохимия и молекулярна биология.
Агрегацията на алфа-синуклеин е отличителен белег на болестта на Паркинсон и други синуклеинопатии. Това е динамичен процес, при който протеинът се самосглобява, за да образува олигомери, които в крайна сметка се развиват в токсични амилоидни фибрили, натрупващи се в мозъка на пациента.
Алфа-синуклеиновите олигомери играят ключова роля в развитието и прогресията на заболяването и следователно са обещаващи терапевтични и диагностични цели, особено в ранните стадии на заболяването. Въпреки това, техният преходен и силно динамичен характер ограничава изучаването на тяхната структура и усложнява разработването на терапии, насочени към тяхното блокиране.
В предишно проучване изследователите открили, че малка молекула, бактериалният пептид PSMα3, инхибира агрегацията на алфа-синуклеин чрез свързване с олигомери, блокирайки фибрилизацията и потискайки невротоксичността. В това проучване те определили къде, как и кога се случва това свързване в олигомерите, идентифицирайки ключов регион за процеса на структурна конверсия, свързан с патогенезата на болестта на Паркинсон.
„Идентифицирахме структурна последователност, необходима за превръщането на олигомерите във фибрили, като по този начин отворихме ново поле за разработване на молекули, насочени към олигомерите. Използвайки това поле, можем да проектираме нови молекули, които имитират свойствата на PSMα3 с много по-голям афинитет и ефикасност“, обяснява Вентура, директор на Изследователската група за сгъване на протеини и конформационни заболявания в IBB и координатор на изследването.
Комбинирайки структурни, биофизични и биохимични анализи, изследователите откриха, че PSMα3 действа чрез свързване с единия край на алфа-синуклеина (N-терминала), който регулира процеса на превръщане на олигомерите във фибрили. Когато е свързан, пептидът покрива два малки съседни региона на протеина, P1 и P2, за които е доказано, че са критични за този патологичен преход.
„Този регион е идеална терапевтична цел, защото се разпознава от пептидите само когато са част от олигомери, което ни позволява да се насочим към агрегатите, без да засягаме функционалната мономерна форма на алфа-синуклеин, която е от съществено значение за нормалната мозъчна функция“, казва Вентура.
Проучването има значение и за по-доброто разбиране на молекулярните механизми на наследствената форма на болестта на Паркинсон. Тази форма, която обикновено засяга хора в по-млада възраст, често е свързана с мутации, разположени в P2 региона на алфа-синуклеина, като например мутацията G51D, която причинява една от най-агресивните форми на заболяването.
Изследователите показаха, че мутацията G51D в идентифицирания критичен регион причинява конформационни флуктуации, които забавят превръщането на олигомерите във фибрили. Това забавяне води до натрупване на токсични, дългоживеещи олигомери, които се обработват неефективно от молекулярни шаперони, които се опитват да ги дезагрегират.
„Нашето откритие може да доведе до разработването на специфични пептиди, които могат да се насочат към тези мутирали форми на алфа-синуклеин и следователно до персонализиран подход към терапията за страдащите от наследствената форма на болестта на Паркинсон. Вече работим по разработването на тези молекули“, казва Вентура.
