
Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Ново устройство подобрява генерирането на стволови клетки за терапия на Алцхаймер
Последно прегледани: 02.07.2025

Изследователи в Швеция твърдят, че са усъвършенствали техника за превръщане на обикновени кожни клетки в невронни стволови клетки, което според тях ги доближава до достъпни персонализирани клетъчни терапии за болестта на Алцхаймер иПаркинсон.
Използвайки специално разработено микрофлуидно устройство, изследователският екип е разработил безпрецедентен и ускорен подход за препрограмиране на човешки кожни клетки в индуцирани плурипотентни стволови клетки (iPSCs) и след това превръщането им в невронни стволови клетки.
Първият автор на изследването, Саумя Джайн, казва, че платформата може да подобри и намали разходите за клетъчна терапия, като направи клетките по-съвместими и по-приемани от тялото на пациента. Изследването е публикувано в списанието Advanced Science от учени от Кралския технологичен институт KTH.
Анна Херланд, старши автор на изследването, заяви, че проучването демонстрира първото използване на микрофлуидика за насочване на iPSC да се превърнат в невронни стволови клетки.
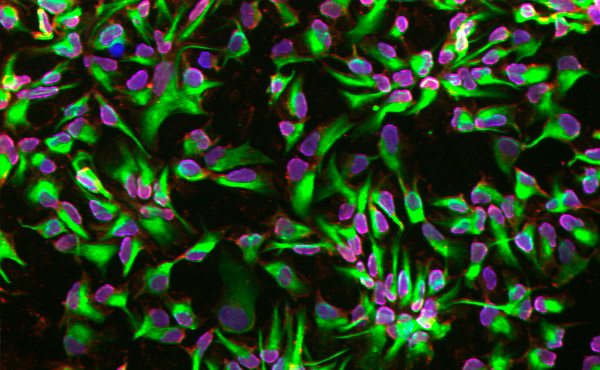
Невронни стволови клетки, диференцирани с помощта на микрофлуидна платформа. Снимка: Кралски технологичен институт KTH
Трансформацията на нормалните клетки в неврални стволови клетки всъщност е двуетапен процес. Първо, клетките са изложени на биохимични сигнали, които ги индуцират да се превърнат в плурипотентни стволови клетки (iPSCs), които могат да генерират различни видове клетки.
След това те се прехвърлят в култура, която имитира сигналите и процесите на развитие, участващи във формирането на нервната система. Тази стъпка, наречена неврална диференциация, пренасочва клетките към превръщането им в неврални стволови клетки.
През последното десетилетие лабораторната среда за този тип работа постепенно се измести от традиционните таблети към микрофлуидни устройства. Херланд казва, че новата платформа представлява подобрение в микрофлуидиката и за двата етапа: генериране на iPSC и диференциация на невронни стволови клетки.
Използвайки клетки от биопсии на човешка кожа, изследователите установили, че микрофлуидната платформа ускорява ангажирането на клетките с невронна съдба на по-ранен етап в сравнение с тези, диференцирани в конвенционални плаки.
„Документирахме, че ограничената среда на микрофлуидната платформа засилва ангажимента за генериране на невронни стволови клетки“, казва Херланд.
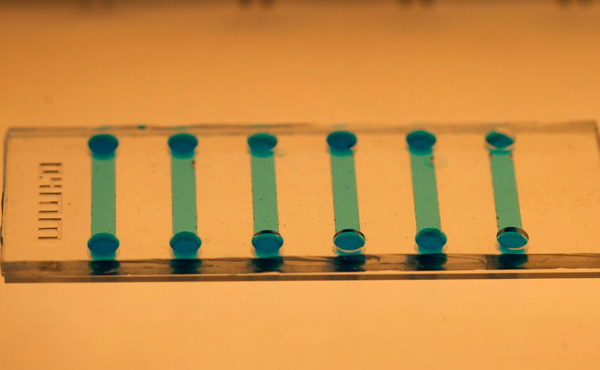
Изглед отблизо на микрофлуидния чип, използван за индуциране на стволови клетки. Снимка: Кралски технологичен институт KTH
Джейн казва, че микрофлуидният чип е лесен за производство с помощта на полидиметилсилоксан (PDMS), а микроскопичният му размер позволява значителни икономии на реагенти и клетъчен материал.
Платформата може лесно да бъде модифицирана, за да се позволи диференциация в други клетъчни типове, добавя той. Тя може да бъде автоматизирана, осигурявайки затворена система, която гарантира последователност и надеждност при производството на високо хомогенни клетъчни популации.

Общ преглед на изследването, включващо изработване на устройства, препрограмиране на соматични клетки в индуцирани плурипотентни стволови клетки (iPSCs) и невронна индукция на iPSCs, използвайки протокола за двойно инхибиране SMAD за генериране на невронни стволови клетки.
A) Процес на изработване на микрофлуидно устройство с канали с височина 0,4 мм и 0,6 мм за препрограмиране на соматични клетки (R) и невронна индукция (N), съответно. Обемите на каналите и общият обем са изброени в таблицата.
B) Общ преглед на процеса на препрограмиране на соматични клетки в iPSCs върху микрофлуидни устройства и плаки, използвайки mRNA трансфекция.
C) Общ преглед на процеса на невронна индукция на iPSCs в невронни стволови клетки върху микрофлуидни устройства и плаки, използвайки протокола за двойно инхибиране SMAD.
Източник: Advanced Science (2024). DOI: 10.1002/advs.202401859
„Това е стъпка към осигуряване на достъп до персонализирани клетъчни терапии за болестите на Алцхаймер и Паркинсон“, добавя Джейн.
В проучването участваха и учени от Каролински институт и университета в Лунд, които си сътрудничат в консорциума IndiCell.
