
Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Нови генетични механизми могат да бъдат терапевтична цел срещу глиома
Последно прегледани: 02.07.2025
 ">
">Проучване от лабораторията на д-р Ши-Юан Ченг, професор в отделението по невроонкология „Кен и Рут Дейви“ към катедрата по неврология, идентифицира нови механизми, лежащи в основата на алтернативни събития на сплайсинг на РНК в туморни клетки на глиома, които могат да служат като нови терапевтични цели. Резултатите от проучването са публикувани в Journal of Clinical Investigation.
„Открихме различен начин за лечение на глиома през призмата на алтернативното снаждане и открихме нови мишени, които не са били идентифицирани преди това, но са важни за злокачествеността на глиома“, каза д-р Сяо Сонг, доцент по неврология и водещ автор на изследването.
Глиомите са най-често срещаният вид първичен мозъчен тумор при възрастни и произхождат от глиални клетки, които се намират в централната нервна система и поддържат съседните неврони. Глиомите са силно устойчиви на стандартни лечения, включително лъчетерапия и химиотерапия, поради генетичната и епигенетичната хетерогенност на тумора, което подчертава необходимостта от намиране на нови терапевтични цели.
Предишни изследвания от лабораторията Ченг, публикувани в списанието Cancer Research, показват, че важният сплайсинг фактор SRSF3 е значително повишен в глиомите в сравнение с нормалните мозъци, а SRSF3-регулираният РНК сплайсинг насърчава растежа и прогресията на глиома, като повлиява множество клетъчни процеси в туморните клетки.
Сплайсингът на РНК е процес, който включва отстраняване на интрони (некодиращи региони на РНК) и свързване на екзони (кодиращи региони), за да се образува зряла молекула иРНК, която поддържа генната експресия в клетката.
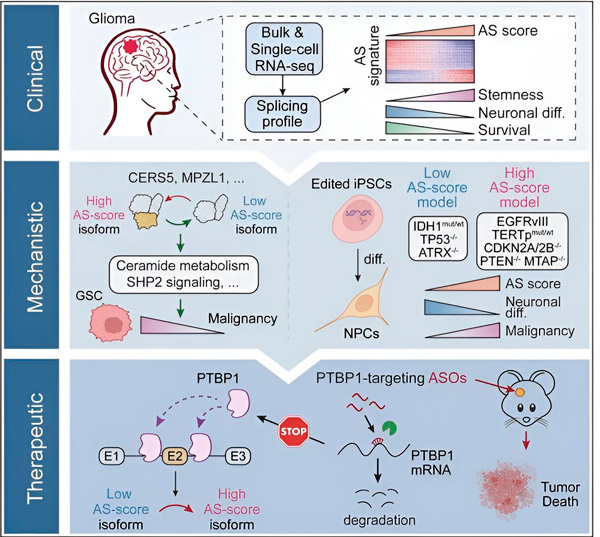
В настоящото проучване учените са се стремели да идентифицират промени в алтернативния сплайсинг в туморните клетки на глиома, механизмите, лежащи в основата на тези промени, и да определят техния потенциал като терапевтични цели.
Използвайки изчислителни методи и технологии за РНК секвениране, изследователите изследвали промените в сплайсинга в туморни клетки на глиома от проби от пациенти. За да потвърдят тези промени, те използвали CRISPR технологии за редактиране на гени, за да въведат различни мутации на глиомния драйвер в модели на глиом, получени от човешки индуцирани плурипотентни стволови клетки (iPSCs).
Те открили, че тези промени в сплайсинга се усилват от вариант на рецептора III на епидермалния растежен фактор (EGFRIII), за който е известно, че е свръхекспресиран в много тумори, включително глиоми, и се инхибират от мутация в гена IDH1.
Изследователите са потвърдили функцията на две събития на сплайсинг на РНК, които създават различни протеинови изоформи с различни аминокиселинни последователности.
„Само една от тези изоформи може да стимулира растежа на тумора, за разлика от другата изоформа, която обикновено се експресира в нормалния мозък. Туморите използват този механизъм, за да експресират селективно тумор-стимулиращата изоформа над нормалната мозъчна изоформа“, каза Сонг.
След това екипът анализира РНК-свързващи протеини нагоре по веригата и установи, че генът PTBP1 регулира тумор-промотиращия РНК сплайсинг в глиомни клетки. Използвайки ортотопичен глиомен модел при имунодефицитни мишки, изследователите насочиха PTBP1 към терапия на базата на антисенс олигонуклеотиди (ASO), която в крайна сметка потисна растежа на тумора.
„Нашите данни подчертават ролята на алтернативния сплайсинг на РНК за повлияване на злокачествеността и хетерогенността на глиома и неговия потенциал като терапевтична уязвимост за лечението на възрастни глиоми“, пишат авторите на изследването.
Следващата стъпка за изследователите е да проучат потенциала на насочване към PTBP1, за да предизвикат противотуморен имунен отговор, каза Сонг.
„Използвайки анализ на RNA секвениране с дълго четене, открихме, че насочването към PTBP1 в глиомни клетки води до производството на множество алтернативно сплайсирани транскрипти, които липсват в нормалните тъкани. Така че следващият ни проект е да разберем дали тази изоформа може да генерира някои антигени, така че имунната система да може по-добре да разпознае тумора“, каза Сонг.
Сонг добави още, че екипът им се интересува от анализ на промените в сплайсинга в нетуморни клетки от пациенти с глиом, като например имунни клетки.
„Вече знаем, че сплайсингът е много важен за регулиране на функцията в клетката, така че той не само трябва да регулира злокачествеността на тумора, но може да регулира и функцията на имунните клетки, за да определи дали те могат ефективно да убиват рака. Затова правим и някои биоинформатични анализи в туморно-инфилтрирани имунни клетки, за да видим дали има промяна в сплайсинга, след като имунна клетка е инфилтрирала тумора.“
„Нашата цел е да определим ролята на алтернативното снаждане в оформянето на имуносупресивната туморна микросреда и да идентифицираме потенциални цели за подобряване на ефикасността на имунотерапиите при глиом“, каза Сонг.
