
Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Витамин K₂ по нов начин: Как един „сиренен“ микроб научи учените да правят витамините по-евтини и по-екологични
Последно прегледани: 18.08.2025
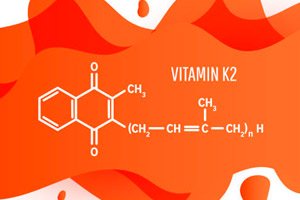 ">
">Екип от университета Райс е открил защо бактериите Lactococcus lactis (същият безопасен „работен кон“ на сирената и кефира) упорито отказват да произвеждат твърде много от прекурсора на витамин K₂ — и как внимателно да „премахнат ограничителите“. Оказа се, че клетките балансират между ползата (хиноните са необходими за енергия) и токсичността (излишъкът им предизвиква оксидативен стрес). Учените са сглобили свръхчувствителен биосензор, „хвърлили жици“ в пътищата на синтез и са свързали математически модел. Заключение: две „завеси“ се намесват едновременно — вградената регулация на пътя и липсата на първоначалния субстрат; плюс това, дори редът на гените в ДНК е важен. Ако регулирате три копчета заедно (субстрат → ензими → ред на гените), таванът на продукцията може да се повиши. Работата е публикувана в mBio на 11 август 2025 г.
Предистория на изследването
- Защо всеки има нужда от витамин K₂? Менахиноните (витамин K₂) са важни за съсирването на кръвта, здравето на костите и вероятно кръвоносните съдове. Търсенето на добавки нараства, а класическият химичен синтез е скъп и не е най-екологичният. Логичното решение е K₂ да се произвежда чрез ферментация върху безопасни хранителни бактерии.
- Защо Lactococcus lactis? Той е работният кон на млечната индустрия, със статус GRAS. Лесен е за култивиране, безопасен е и вече се използва в храните – перфектната основа за превръщането на микроба във витаминна биофабрика.
- Къде е истинската задънена улица? Пътят на биосинтеза на K₂ преминава през реактивни хинонови междинни продукти. От една страна, те са необходими на клетката (енергия, електронен пренос), но от друга страна, в излишък стават токсични (оксидативен стрес). Следователно, дори ако „настроите“ ензимите, самата клетка определя ограничения върху скоростта на потока.
- Какво липсваше преди.
- Точни измервания на нестабилни междинни метаболити - те са трудни за „улавяне“ със стандартни методи.
- Разбиране дали ниският резултат се дължи на регулация на пътя, липса на начален субстрат или... често пренебрегваната архитектура на оперона (реда на гените в ДНК).
- Защо тази работа. Авторите се нуждаеха от:
- създайте чувствителен биосензор, който най-накрая да измери „хлъзгавите“ междинни продукти;
- сглобете модел на цялата каскада и разберете къде са истинските „пречки“;
- да се тества как три копчета едновременно влияят на освобождаването - снабдяването със субстрат, нивата на ключови ензими и реда на гените - и дали е възможно да се пробие естественият таван чрез едновременното им завъртане.
- Практически смисъл. Ако разберете къде точно микробът „се забавя“, можете да проектирате щамове, които произвеждат повече витамин със същите ресурси и правят производството по-евтино и по-екологично. Това е полезно и за други пътища, където „полезните“ хинони са на ръба на токсичността – от витамини до лекарствени прекурсори.
Какво точно направиха?
- Беше уловен невидим междинен продукт. Прекурсорът, от който се сглобяват всички форми на витамин К₂ (менахинон), е много нестабилен. За да го „видят“, беше направен персонализиран биосензор в друга бактерия - чувствителността се увеличи хиляди пъти, а за измерванията беше достатъчно просто лабораторно оборудване.
- Те промениха генетиката и я сравниха с модела. Изследователите промениха нивата на ключови ензими от пътя и сравниха действителното освобождаване на прекурсора с прогнозите на модела. Докато моделът приемаше, че субстратът е „безкраен“, всичко се размина. Струваше си да се вземе предвид изчерпването на началото и прогнозите „дойдоха“ на мястото си: сблъскваме се не само с ензими, но и със суровини за пътя.
- Беше открита ролята на ДНК „архитектурата“. Дори редът на гените в ензимната каскада влияе върху нивото на нестабилния междинен продукт. Пренареждането е дало забележими промени – това означава, че еволюцията използва и геометрията на генома като регулатор.
Ключови открития, казано по-просто
- L. lactis поддържа точно толкова прекурсор, колкото е необходимо, за да оцелее и да расте, без да стане токсичен. Простото „добавяне на ензими“ не помага, ако няма достатъчно субстрат: все едно да сложите още тави за печене, без да добавяте брашно.
- „Таванът“ на производството се определя от две неща едновременно: вътрешната регулация на пътя и наличието на източника. Плюс това, на всичкото отгоре е редът на гените в оперона. Настройването на три нива едновременно ви позволява да отидете отвъд естествения лимит.
Защо е необходимо това?
- Витамин К₂ е важен за съсирването на кръвта, костите и вероятно за здравето на съдовете. В момента се получава чрез химичен синтез или екстракция от суровини - това е скъпо и не е много екологично. Разработването на безопасни хранителни бактерии дава възможност за получаване на К₂ чрез ферментация - по-евтино и „по-екологично“.
- Разбирането къде са „спирачките“ в пътя на синтеза е карта за производителите: възможно е да се създадат щамове, които произвеждат повече витамин при същото количество фураж и площ, а в бъдеще дори пробиотици, които синтезират K₂ директно в продукта или в червата (разбира се, стриктно под регулация).
Цитати
- „Микробите, произвеждащи витамини, имат потенциала да трансформират храненето и медицината, но първо трябва да дешифрираме техните вътрешни „аварийни спирателни кранове“, казва съавторът Каролайн Ахо-Франклин (Университет Райс).
- „Когато взехме предвид изчерпването на субстрата, моделът най-накрая съвпадна с експеримента: клетките достигнаха естествен таван, когато източникът се изчерпи“, добавя Олег Игошин.
Какво означава това за индустрията - точка по точка
- Инструменти: Вече има биосензор за фино управление и модел, който правилно изчислява „пречките“. Това ускорява цикъла „проектиране → проверка“.
- Стратегия за мащабиране: Не се стремете към един „суперензим“. Настройте три елемента: захранване със субстрат → нива на ензими → генен ред. По този начин имате по-голям шанс да пробиете естествения лимит.
- Поносимост: Принципите на баланса полза/токсичност за хиноните се отнасят и за други микроби и пътища, от витамини до антибиотици: твърде много реактивни междинни продукти и спад в растежа.
Къде е предпазливостта?
Това е фундаментална работа върху безопасните хранителни бактерии и в лабораторни условия. Все още има въпроси преди семинара: стабилност на щамовете, регулиране на „функционалните“ продукти, икономика на мащабиране. Но пътната карта - накъде да се обърнем и какво да измерваме - вече съществува.
Обобщение
За да се произведе повече витамин от микроб, не е достатъчно просто да се „даде газ“ на ензим - важно е също така да се осигури гориво и да се сглоби правилната връзка. Проучването на mBio показва как да се настрои субстратът, гените и регулацията заедно, за да се превърне Lactococcus lactis в зелена фабрика за K₂ - и да се направят витамините по-евтини и по-чисти.
Източник: Li S. et al. Ползите за растежа и токсичността на биосинтеза на хинони са балансирани от двоен регулаторен механизъм и ограничения на субстрата, mBio, 11 август 2025 г. doi.org/10.1128/mbio.00887-25.
