Медицински експерт на статията
Нови публикации
Вирусът на човешката имунна недостатъчност (HIV)
Последно прегледани: 23.04.2024

Цялото съдържание на iLive е медицински прегледано или е проверено, за да се гарантира възможно най-голяма точност.
Имаме строги насоки за снабдяване и само свързваме реномирани медийни сайтове, академични изследователски институции и, когато е възможно, медицински проучвания, които се разглеждат от специалисти. Имайте предвид, че номерата в скоби ([1], [2] и т.н.) са линкове към тези проучвания.
Ако смятате, че някое от съдържанието ни е неточно, остаряло или под съмнение, моля, изберете го и натиснете Ctrl + Enter.
Синдром на придобита имунна недостатъчност е идентифициран като конкретна болест през 1981 г. В САЩ, където броят на младите хора да имат сериозни заболявания, причинени от микроорганизми, които не са патогенни или ниски патогенен за здрави индивиди. Проучването на имунния статус на пациентите показва рязко намаляване на броя на лимфоцитите като цяло и по-специално на Т-помагачите. Това заболяване се нарича СПИН (Синдром на придобитата имунна недостатъчност в България - Синдром на придобита имунна недостатъчност или СПИН). Методът на инфекция (сексуален контакт, чрез кръвта и неговите препарати) показва инфекциозния характер на заболяването.
Причинителят на СПИН е бил открит през 1983 г. Независимо французин Л. Монтание, който го нарече LAV лимфоаденопатия Associated Virus), тъй като е установено в лимфни възли на пациентите; и американката Р. Гало, която нарече вируса HTLV-III (английски човешки Т-лимфотропен вирус III): преди това той беше открит лимфотропни вируси I и II.
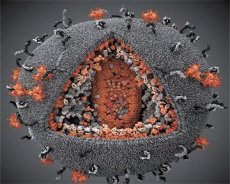
Сравнението на свойствата на вирусите LAV и HTLV-III показва тяхната идентичност, поради което през 1986 г. Вирусът се нарича HIV (вирус на човешката имунна недостатъчност или ХИВ), за да се избегне объркване. ХИВ е сферичен, диаметърът му е 110 nm. Обвивката на вируса има формата на полихедрон, съставен от 12 пентаграма и 20 шестоъгълника. Молекулата на гликозилирания протеин gpl20 е разположена в центъра и ъглите на всеки шестоъгълник (числото 120 означава молекулното тегло на протеина в килодалтони). Общо 72 молекули gpl20 се намират на повърхността на вириона, всяка от които е свързана с вътрем-мембранния протеин gp41. Тези протеини заедно с двойния липиден слой образуват свръхкапсида (мембраната) на вириона.
Протеините gpl20 и gp41 се образуват в резултат на клетъчното протеазно рязане на прекурсорния протеин Env. Протеинът gp41 образува "гръбнака" на гръбнака, свързан от цитоплазмения домен с матричния протеин p17MA непосредствено под мембраната. Молекулите р17, взаимодействащи с узряването на вириона, образуват икозаедър, намиращ се под черупката.
В централната част на вириона, р24 протеинът образува конична капсида. Тясната част на капсида с участието на белтъка рб е свързана с плика на вириона. В рамките на капсида има две еднакви молекули на вирусна геномна РНК. Те са свързани в техните 5 'краища към нуклеокапсидния протеин p7NC. Този протеин е интересен с това, че има две аминокиселинни остатъци (мотив), богат на цистеин и хистидин атом и съдържащи Zn, - те се наричат "цинков пръст", тъй като те улови молекулата на геномна РНК за вграждане в вириони образувани. Капсидът също съдържа три ензима. Реверсаза (RT) или по-комплекс включва реверсивна транскриптаза, RNA-ase Н и ДНК-зависима ДНК полимераза. Ревертазата присъства като р66 / р51 хетеродимер. Протеазата (PR) - pI започва и реализира процеса на узряване на вирион. Интегрирането (IN) - р31 или ендонуклеазата осигурява включването на провирусна ДНК в генома на клетката гостоприемник. Капсидът също съдържа молекула РНК за семе (tRNA1 "3).
РНК генът в клетката се превръща чрез обратна транскриптаза в ДНК геном (DNA-provirus), състоящ се от 9283 нуклеотидни двойки. Ограничава се вляво и отдясно от т. Нар. Повтарящи се дълги краища или LTR (английско дълго терминално повторение): S'-LTR - ляво и Z'-LTR - вдясно. LTR съдържат 638 нуклеотидни двойки.
Геномът на ХИВ се състои от 9 гени, някои от които са припокрити (има няколко рамки за четене) и има екзонинова структура. Те контролират синтеза на 9 структурни и 6 регулаторни протеина.
Стойността на LTR за вирусния геном е, че съдържа следните регулаторни елементи, които контролират неговото функциониране:
- транскрипционен сигнал (промоторна област);
- сигналът за добавяне на поли-А;
- Сигнал за улавяне;
- сигнална интеграция;
- положителен регулаторен сигнал (TAR за TAT протеин);
- елемент на отрицателно регулиране (NRE за NEF протеин);
- мястото на свързване на семената РНК (tRNA ™ 3) за синтеза на минус веригата на ДНК в 3 'края; сигнал в 5'-края на LTR, който служи като праймер за синтеза на плюс-веригата на ДНК.
В допълнение, LTR съдържа елементи, участващи в регулирането на mRNA снаждане, опаковане на vRNA молекулите в капсида (Psi елемент). И накрая, когато се транскрибира генома в дълги mRNAs, се генерират два сигнала за REV протеина, които превключват протеиновата синтеза: CAR за регулаторни протеини и CRS за структурни протеини. Ако REV протеинът се свързва с CAR, се синтезират структурни протеини; ако липсва, се синтезират само регулаторни протеини.
При регулирането на генома на вируса, следните регулиращи гени и техните протеини играят особено важна роля:
- протеин ТАТ, който извършва положителен контрол на възпроизвеждането на вируса и действа чрез регулаторен сайт за ТАР;
- протеини NEV и VPU, извършващи отрицателен контрол на възпроизводството през NRE сайта;
- белтъка REV, провеждащ положителен отрицателен контрол. REV протеинът контролира работата на гените gag, pol, env и извършва отрицателно регулиране на снаждането.
По този начин възпроизводството на ХИВ е под троен контрол - положителен, отрицателен и положителен-отрицателен.
VIF протеинът определя инфективността на ново синтезирания вирус. Той се свързва с капсидния протеин р24 и присъства във вириона в количество от 60 молекули. НЕФ протеинът е представен във вирион с малък брой молекули (5-10), вероятно свързани с плика.
ВПР протеин инхибира клетъчния цикъл в G2 фазата, участващи в комплексите транспорт preintegratsionnyh в ядрото на клетката и активира някои вирусни и клетъчни гени, повишава ефективността на вирусната репликация в моноцити и макрофаги. Не е установено местоположението на протеините VPR, TAT, REV, VPU във вириона.
В допълнение към собствените си протеини, съставът на вирионната мембрана може да включва някои протеини на клетката гостоприемник. Протеините VPU и VPR участват в регулирането на вирусното възпроизвеждане.
Антигенни варианти на вируса на човешката имунна недостатъчност (HIV)
Вирусът на човешката имунна недостатъчност (ХИВ) е много променлив. Дори от организма на един пациент, щамове на вируса, които се различават значително в антигенните свойства, могат да бъдат изолирани. Такава променливост се насърчава чрез интензивно разрушаване на CD4 + клетки и мощен антитяло отговор на HIV инфекция. Пациентите от Западна Африка имат нова форма на ХИВ, биологично близка до HIV-1, но имунологично различна от нея, HIV-2. Хомологията на първичната структура на геномите на тези вируси е 42%. ДНК-провирусът HIV-2 съдържа 9671 bp и неговия LTR - 854 bp. HIV-2 впоследствие е изолиран в други региони на света. Няма кръстосан имунитет между HIV-1 и HIV-2. Две големи форми на HIV-1 са известни: O (Outlier) и M (Major), последните са разделени на 10 подтипа (AJ). В Русия се разпространяват 8 подтипа (AH).
Механизмът на взаимодействие на ХИВ с клетката
След като проникне в тялото, вирусът първо атакува клетки, съдържащи специфичен CD4 рецептор. Този рецептор има голям брой Т-помощници, в по-малка степен - макрофаги и моноцити, особено чувствителните към вируса Т-помощници.
Вирусът на човешката имунна недостатъчност (HIV) разпознава CD4 рецепторите с неговия gpl20 протеин. Процесът на взаимодействие на ХИВ с клетката протича съгласно следната схема: рецепторно-медиирана адсорбция -> гранична фовея -> граничен везикул -> лизозом. В него вирионната мембрана се слива с лизозомната мембрана, а нуклеокапсидът, освободен от суперкапсида, навлиза в цитоплазмата; по пътя към ядрото се унищожава и се освобождават геномната РНК и свързаните ядрени компоненти. След това, на обратната транскриптаза синтезира на вирион РНК-минус ДНК верига, последвано от рибонуклеаза Н разрушава вирион РНК и вирусна ДНК полимераза синтезира ДНК плюс верига. В краищата на ДНК-провирус се образува 5'-LTR и 3'-LTR. ДНК-провирусът може да бъде в ядрото за известно време в неактивна форма, но рано или късно той се интегрира с помощта на своята интеграза в хромозомата на целевата клетка. В него провирусът е в неактивно състояние, докато този Т-лимфоцит се активира от микробни антигени или други имунокомпетентни клетки. Активирането на транскрипцията на клетъчната ДНК се регулира от специален ядрен фактор (NF-kB). Той е ДНК-свързващ протеин и се произвежда в големи количества по време на активирането и пролиферацията на Т-лимфоцити и моноцити. Този протеин се свързва със специфични последователности на клетъчна ДНК и сходни последователности на LTR ДНК-провирус и индуцира транскрипция както на клетъчна ДНК, така и на ДНК-провирус. Чрез индуциране на транскрипцията на ДНК-провирус, той превключва вируса от неактивно състояние в активна и съответно постоянна инфекция в производствена. Оставането на провирус в неактивно състояние може да продължи много дълго време. Активирането на вируса е критичен момент в взаимодействието му с клетката.
От момента, в който вирусът навлезе в клетката, започва период на заразяване с ХИВ - вирус, който може да продължи 10 години или повече; и тъй като активирането на вируса започва заболяването - СПИН. С помощта на техните регулаторни гени и техните продукти, вирусът започва да се размножава активно. ТАТ-протеинът може да увеличи скоростта на възпроизвеждане на вируса 1000 пъти. Транскрипцията на вируса е сложна. Тя включва формирането както на пълните дължини, така и на субгеномните иРНК, сплайсирането на тРНК и по-нататъшния синтез на структурни и регулаторни протеини.
Синтезът на структурни протеини се извършва както следва. Първоначално синтезира полипротеин прекурсор Pr55Gag (протеин с м. М. 55 кД). Тя съдържа четири основни области: матрица (МА), капсиден (СА), нуклеокапсиден (NC) и РЕ домейни, на които водят рязане Pr55Gag вирусна протеаза (това samovyrezaetsya от друг протеин прекурсор - Gag-Pol) са оформени съответно структурни протеини р17 , р24, р7 и рЬ. Образование Pr55Gag полипротеин - главното условие за формирането на вирусните частици. Именно този протеин се определя програма вириона морфогенеза на. Тя включва стъпки на последователно Gag полипротеин транспорт към плазмената мембрана и нейното взаимодействие с протеин-протеин взаимодействия в образуването на вирусна частица и пъпкуване. Pr55Gag синтезирани от свободни polyribosomes; Протеинови молекули се транспортират до мембраната, която е закрепена от техните хидрофобни региони. Основната роля в създаването на нативната конформация на протеина играе Gag-CA домейн. Ключ NC-домейн осигурява (с помощта на "цинкови пръсти") 2 молекула на геномна РНК в вирусни частици формоване. Полипротеин първа молекула димеризира чрез взаимодействието на матрични домени. След димери комбинирани в хексамерни (6 единици) комплекси от взаимодействието домейни СА и NC. Накрая, хексамери, свързващи странични повърхности представляват незрели вириони сферична форма, в които съдържат вирусна геномна РНК заловен NC-домейн.
Друг прекурсорен протеин Prl60Gag-Pol (протеин с м. М. 160 Ша) се синтезира в резултат на изместване на рамка на четене на рибозомата по време на транслация Z'-края на GAG ген в дадена зона непосредствено преди кодиращата област RB протеин. Този полипротеин Gag-Pol съдържа непълна последователност от Gag протеин (1 - 423 аминокиселини) и Pol последователности, които включват PR, RT и IN домейни. Молекулите на полипротеин Gag-Pol също се синтезират върху свободни полирибозоми и се транспортират до плазмената мембрана. Полипротеин Prl60Gagpol съдържа всички места на междумолекулни взаимодействия, присъщи на полипротеиновите Gag и мембранни свързващи места. Следователно, молекулите на полипротеин Gag-Pol предпазител с мембраната и, заедно с Gag-молекули включват образуващи вириони, които могат да доведат до започва активен процес на зреене протеаза и вирион. HIV-1 протеазата е силно активна само под формата на димер, следователно за нейното самоизрязване от Prl60Gag-Pol, е необходима димеризация на тези молекули. Насищане на вириона е, че освободената активна протеаза разрязва prl60Gag-Pol и Gag55 в разпознаваеми места; протеини р17, р24, р7, р6, ревертаза, интеграза се образуват и се свързва във вирусната структура.
Env протеин се синтезира на рибозоми, свързани с мембраните на ендоплазмения ретикулум, гликозилиран и след това се нарязва клетъчна протеаза към др120 и др41 и се транспортират към повърхността на клетката. В този случай gp41 прониква в мембраната и се свързва към матричните домени на Gag протеиновата молекула, свързана с вътрешната повърхност на мембраната. Тази връзка продължава в зрелия вирион.
По този начин, комплект от вирусни частици е агрегиране на прекурсорни протеини и свързаните РНК молекули върху плазмената мембрана на клетката гостоприемник, образуване на незрели вириони и тяхното освобождаване от обещаващ от клетъчната повърхност. При поникване вирионът се заобикаля с клетъчна мембрана, в която са вградени молекулите gp41 и gp120. По време на начинаещи или евентуално след освобождаване на вирион съзряване настъпва, което се извършва с помощта на вирусна протеаза е протеолитично рязане Pr55Gag прекурсорни протеини и Prl60Gag-Pol вирус на зрели протеини и тяхната връзка със специфични структурни комплекси. Водеща роля в морфогенезата на вируса играе полипротеин прекурсор Pr55Gag, който организира и сглобява незрели вирион; Процесът на нейното узряване се допълва от специфична вирусна протеаза.
Причини за имунна недостатъчност
Една от основните причини за имунна недостатъчност при ХИВ инфекция е масивна загуба на Т-хелперни клетки. Това се случва поради следните събития. Първо, инфектирани с вирус на Т-хелперни клетки умират поради апоптоза. Смята се, че пациенти с вируса на СПИН репликация, апоптоза и намаляване на броя на Т-хелперни клетки са свързани помежду си. Второ, Т-клетки убийци разпознаят и унищожат Т-клетки, инфектирани с вирус или носеща молекула адсорбирания gpl20, както и заразени с вирус и вирус-инфектираните Т-хелперните клетки, които образуват symplasts (синцитий), състояща се от няколко десетки клетки (част от умрат в резултат на вируса на размножаване а). Поради разрушаването на голям брой на Т-хелперни клетки настъпва намаление мембрана рецепторна експресия в В лимфоцити на IL-2, нарушен синтез на различни интерлевкини (растежни фактори и диференцирането на В-лимфоцити -. IL-4, IL-5, IL-6, и други) Получената в разстрои функция на режима на Т-убийци. А подтискане на активността на системата на комплемента и макрофагите. Инфектирани с вируса макрофаги и моноцити дълго, за да умре, но те не са в състояние да премахне вируса от тялото. Накрая, поради структурните и антигенни сходства с рецептори gpl20 някои епителни клетки на организма (включително трофобласти рецептор, медииране на предаване на ХИВ трансплантация) се синтезира antiretseptornyh антитела с широк спектър на действие. Тези антитела са способни да блокират различни клетъчни рецептори и усложняват хода на заболяването автоимунни разстройства. В резултат на ХИВ инфекцията е победил всички основни части на имунната система. Такива пациенти са беззащитни срещу голямо разнообразие от микроорганизми. Това води до развитието на техните опортюнистични инфекции и неопластични заболявания. За HIV-инфектирани пациенти са изложени на повишен риск от развитие на рак с най-малко три типа сарком на Капоши; карциноми (включително рак на кожата); В-клетъчен лимфом, произтичащи от злокачествена трансформация на В-лимфоцити. Въпреки това, ХИВ има не само limfotsito- но Невротропни. Тя прониква в CNS клетки (астроцити) или чрез рецептор-медиирана ендоцитоза и фагоцитоза на астроцити с инфектирани с вирус лимфобласти. При взаимодействието на вируса с астроцитите също са оформени symplasts благоприятни за разпространението на патогена междуклетъчни канали. В макрофаги и моноцити, вирусът може да се запази за дълго време, така че те служат като резервоар и неговите дистрибутори в тялото, е в състояние да проникне във всички тъкани. Инфектираните макрофаги играе главната роля в дрейф на ХИВ в централната нервна система и нейното поражение. В 10% от пациентите с свързани с централната нервна система и са показани под формата на деменция (деменция) първични клинични синдроми. По този начин, за хора, засегнати от HIV инфекция се характеризира с 3 групи заболявания - опортюнистични инфекции, туморни заболявания и CNS.
Епидемиология на HIV инфекцията
Източникът на HIV инфекция е само човек - болен или вирусен носител. Вирусът на човешката имунна недостатъчност (HIV) се открива в кръвта, спермата, цервикалната течност; при кърмещи майки - в майчиното мляко. Инфекцията възниква сексуално, чрез кръвта и нейните лекарства, както и от майка на дете преди раждането, по време и след раждането. Случаите на инфекция от вируса чрез храна, напитки и чрез ухапвания от насекоми не са известни.
Наркоманиите допринасят за разпространението на СПИН. ХИВ инфекцията се увеличава всяка година. Според СЗО от 1980 до 2000 г. 58 милиона души са заразени с ХИВ. Само през 2000 г. В света бяха заразени 5,3 милиона души и 3 милиона души загинаха от СПИН. В Русия от 1 януари 2004 г. Са регистрирани 264 000 HIV-позитивни лица. Половината от заразените с ХИВ умират в рамките на 11-12 години от инфекцията. В началото на 2004 г. От всеки 100 000 руски граждани около 180 живееха с диагнозата "HIV инфекция". Предвижда се, че при това ниво на разпространение общият брой на заразените с ХИВ лица в Русия до 2012 г. Ще бъде 2,5-3 милиона души. Сложността на борбата срещу HIV инфекцията зависи от редица причини: първо, няма ефективни методи за нейното лечение и специфична превенция; Второ, инкубационният период за HIV инфекция може да надхвърли 10 години. Неговата продължителност зависи от момента на активиране на Т-лимфоцитите и ДНК-провирусите, съдържащи се в неговата хромозома. Все още не е ясно дали всеки вирус, заразен със СПИН, е обречен или е вероятно да има дългосрочен вирус без заболяване (което изглежда малко вероятно). И накрая, съществуват няколко човешки имунодефицитни вируса (HIV-1, HIV-2), антигенните разлики между които предотвратяват образуването на кръстосан имунитет. Откриването на вируса на имунната недостатъчност на маймуните (SIV) хвърля светлина върху произхода на ХИВ. SIO за организиране на генома е подобно на ХИВ, но се различава значително в нуклеотидната последователност. HIV-2 серологично заема междинна позиция между HIV-1 и SIV и нуклеотидната последователност е по-близо до SIV. В тази връзка VM Zhdanov предполага, че вирусите HIV-1, HIV-2 и SIV произхождат от общ предшественик. Възможно е, според Р. Гало, една от SIV да попадне по някакъв начин в човешкото тяло, където е претърпял редица мутации, които са довели до ХИВ-1, ХИВ-2 и други форми.
Симптомите на ХИВ инфекцията
Вирусът на човешката имунна недостатъчност се характеризира с някои признаци, от които до голяма степен зависи патогенезата на заболяването. Вирусът има много висока степен на репродукция, определена от неговите регулаторни елементи (5,000 вириони се синтезират в рамките на 5 минути на активния стадий). Поради наличието на слетия протеин (gp41) вирус индуцира образуването на големи синцитиални структури чрез сливане както инфектирани и неинфектирани Т-хелперни клетки, което води до тяхната маса смърт. Което води до голям брой протеинови молекули gpl20 свободно циркулират в кръвта и се свързват с рецептори на неинфектирани Т-хелперни клетки, в резултат на което те също са признати и унищожени от Т-убийци. Вирусът може да се разпространи през междуклетъчните канали от клетката в клетката, в този случай тя става по-малко достъпна за антителата.
Клинични критерии за HIV инфекция
Възрастни HIV установи дали те имат най-малко две тежки симптоми в комбинация с най-малко един симптом на незначително в отсъствието на други известни причини за имунна недостатъчност (рак, вроден имунодефицит, тежка глад, и така нататък. П.). Сериозните симптоми включват:
- загуба на тегло с 10% или повече;
- продължителна треска, прекъсвания или персистиращи;
- хронична диария.
Незначителни симптоми включват постоянна кашлица, генерализирано дерматит, рецидивиращ херпес зостер, кандидоза на устната кухина и фаринкса, хронична херпес симплекс, генерализирана лимфаденопатия. Диагнозата на СПИН се прави с наличието само на сарком на Капоши, криптококов менингит, пневмоцистна пневмония. Клиничната картина на заболяването е повлияна от опортюнистична инфекция.
Методи за култивиране на човешки имунодефицитен вирус (HIV)
HIV-1 и HIV-2 могат да се култивират в клетките само на един клон TCB4-лимфоцити - H9, получени от левкемични TCV4-лимфоцити. Еднослойни култури от астроцитни клетки също могат да бъдат използвани за тези цели, в които HIV-1 се умножава добре. От животни до вирусоподобни шимпанзета.
Съпротивлението на вируса във външната среда е ниско. Той умира под въздействието на слънчева светлина и ултравиолетово облъчване, унищожава се при 80 ° C в продължение на 30 минути, когато се третира с обичайно използваните дезинфектанти - в продължение на 20-30 минути. За дезинфекциране на съдържащия вирус материал е необходимо да се използват микобактерицидни дезинфектанти, тъй като те са ефективни срещу микроорганизми с най-висока устойчивост.
Лабораторна диагностика на HIV инфекция
Основният начин за диагностициране на вируса и ХИВ инфекцията е ензимният имуноанализ. Въпреки това, поради факта, че gpl20 има структурна и антигенен сходство с рецептори на някои човешки клетки, включително рецептори, които извършват транспорт на имуноглобулини чрез епителни клетки на лигавицата в тялото могат да се появят антитела свързани антитела срещу gpl20. В този случай може да има фалшиви положителни резултати от IFM. Следователно, всички положително реагиращи серуми на изследваните се подлагат на допълнителен анализ чрез метода на имуноблот или Western blotting. Този метод се основава на идентифицирането на антителата, които трябва да бъдат изследвани след електрофоретично разделяне и последващо тестване с маркирани антивирусни антитела. Вирусологичният метод има малка полза поради сложността на културата на вируса. Използва се клон от Н9 лимфоцити за получаване на вирусни антигени - необходимите компоненти на системите за диагностични тестове. Методът CDR прави възможно откриването на вируса още в ранен стадий на виремия.
Лечение на HIV инфекция
Необходимо е да се намерят или синтезират лекарства, които ефективно инхибират активността на обратната транскриптаза (ревертаза) или вирусната протеаза. Те биха предотвратили образуването на ДНК-провирус и (или) инхибират вътреклетъчното размножаване на вируса. Modern стратегия за лечение на HIV-инфектирани пациенти се основава на принципа на комбинирана употреба на лекарства, които инхибират вирусната протеаза (едно от лекарствата) и revergazu (2 различни лекарството), - комбиниран (тройни) терапия. В Русия, за лечение на ХИВ-позитивни хора препоръчва комбинираното използване на две местни лекарства: Crixivan Phosphazide и по-специално потискат размножаването на ХИВ в ранните и късните етапи на отглеждане, по-специално с намалена активност на AZT.
Проблемът на специфичната превенция е необходимостта от създаване на ваксина, която да осигури формирането на ефективен клетъчно-медииран имунитет, основаващ се на вирус-специфични цитотоксични лимфоцити, без да има значително производство на антитела. Този имунитет се осигурява от Thl-помощници. Възможно е антителата, включително неутрализирането на вируса, да са не само неефективни при потискане на HIV инфекцията, но при високо ниво да потискат клетъчно-медиирания имунитет. Следователно, анти-HIV ваксината трябва да отговаря преди всичко на две основни изисквания: а) да бъде абсолютно безопасна и б) да стимулира активността на Т-цитотоксичните лимфоцити. Проучва се ефективността на различните варианти на ваксини, получени от убити (инактивирани) вируси и от отделни антигени с високи защитни свойства. Такива антигени могат или да бъдат изолирани от самите вириони, или химически синтезирани. Предлага се ваксина, базирана на методи за генно инженерство. Това е рекомбинантен ваксиния вирус, който носи HIV гени, отговорни за синтеза на антигени със силни имуногенни свойства. Решението за ефективността на тези ваксини отнема значително време поради дългия период на инкубация на ХИВ инфекцията и високата променливост на патогена. Създаването на високоефективна ваксина срещу ХИВ е неотложен основен проблем.


 [
[